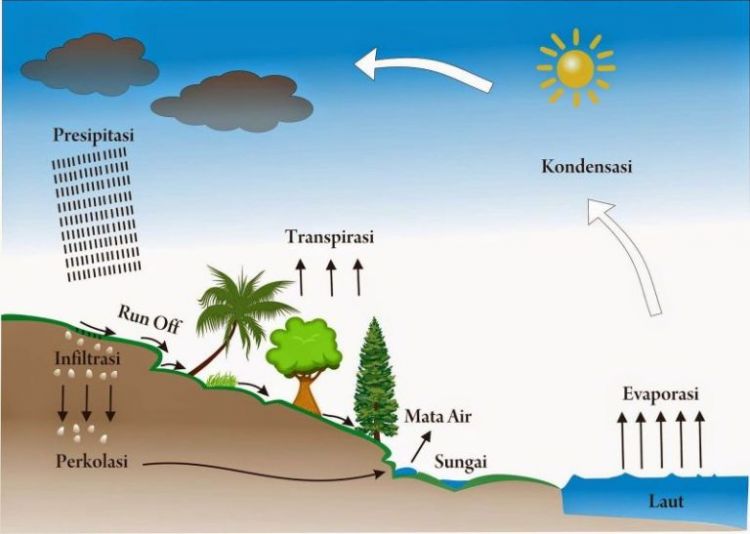
3 Siklus Terbentuknya Air Pengertian dan Jenis Jenisnya Lengkap Penjaskes.Co.Id
Zat yang dalam air dapat melepaskan ion OH- disebut - 19439947 tettymariana8469 tettymariana8469 17.11.2018 Biologi Sekolah Menengah Pertama terjawab Zat yang dalam air dapat melepaskan ion OH- disebut 2 Lihat jawaban Iklan Iklan syanti07 syanti07 Zat yang melepaskan ion OH- didalam air disebut Larutan Basa Iklan Iklan

Pasangan Rumus Kimia Dan Nama Senyawa Yang Benar Adalah Homecare24
Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H+, sedangkan basa adalah zat yang dalam air melepaskan ion OH-. Jadi pembawa sifat asam adalah ion H+, sedangkan pembawa sifat basa adalah ion OH-. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut. Jumlah ion H+, yang dapat dihasilkan oleh 1.

Teori Asam Basa
Lalu Basa Menurut Teori Asam Basa Arrhenius adalah Senyawa atau Zat yang didalam Air dapat menghasilkan suatu Ion Hidroksida (OH-) dan Basa berdasarkan Ion OH- yang dilepaskan pd reaksi Ionisasi basa dibedakan menjadi Basa Monohidroksi yang mempunyai pengertian suatu Basa yang bereaksi pada Ionisasi melepaskan Satu Ion OH-.. Adapun untuk Kelemahan Teori Asam dan Basa Arrhenius ialah tidak.
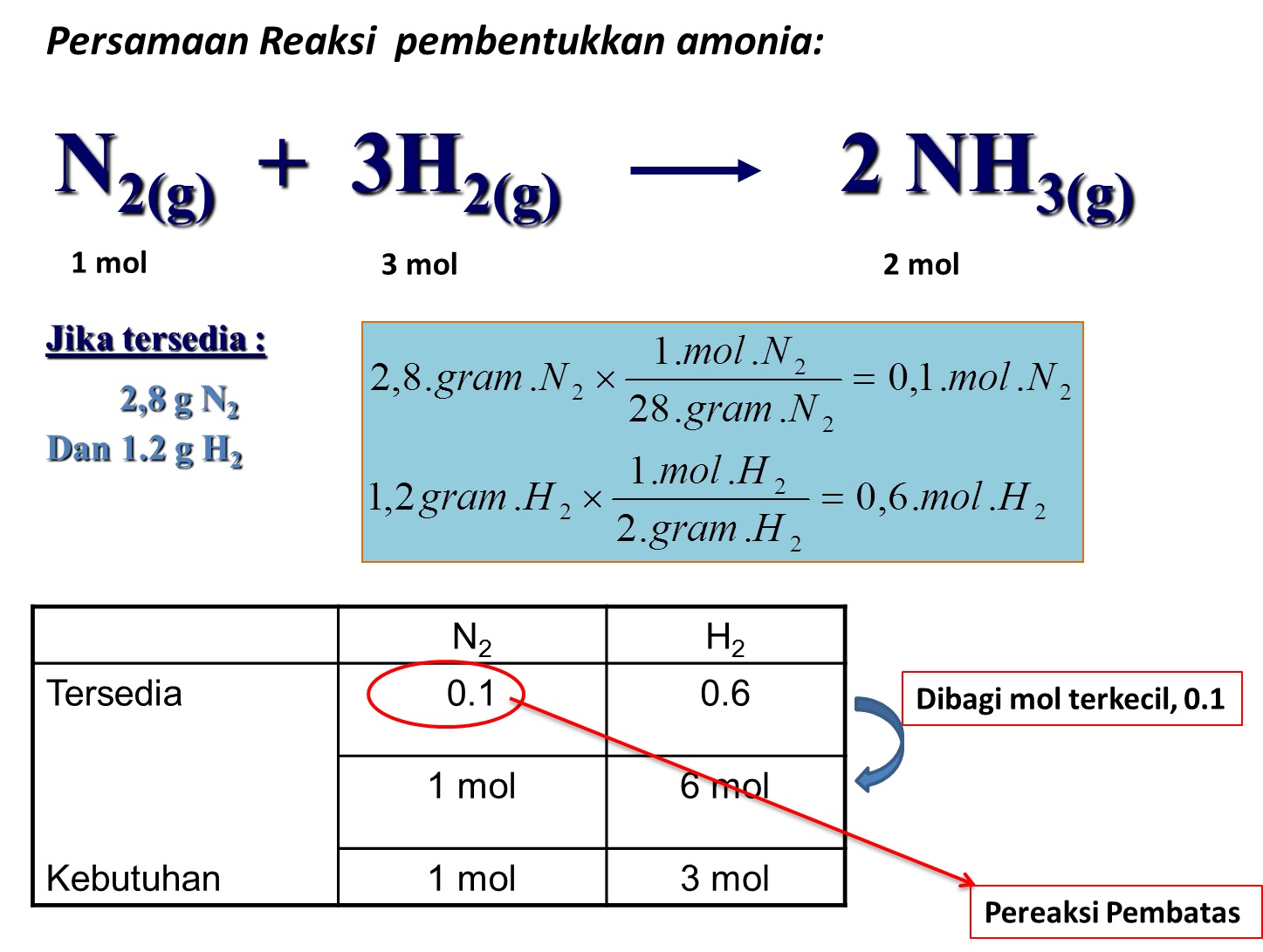
5 Tahapan Reaksi Kimia kabarmedia.github.io
Asam kuat merupakan asam yang jika dilarutkan dalam air mudah melepaskan ion H+, larutan tersebut akan mengalami disosiasi total dalam larutan. Contoh asam kuat yaitu HCl, HNO3, H 2 SO4, dan HClO4. Sementara basa kuat adalah senyawa basa yang jika dilarutkan dalam air mudah melepaskan ion OH-, larutan basa ini juga akan mengalami disosiasi total.

perbedaan senyawa ion dan senyawa kovalen Karen Welch
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.
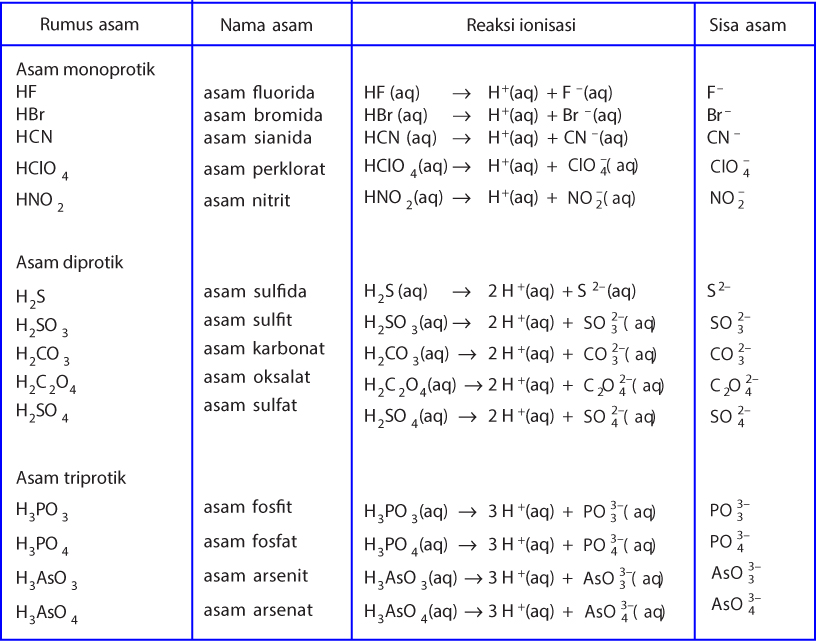
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Ketika suatu zat dimasukkan ke dalam air, lalu dia melepaskan ion H+ maka disebut sebagai zat asam. Sementara jika dia melepaskan ion OH- maka disebut zat basa. Kekuatan elektrolit kedua larutan ini ditentukan oleh banyaknya ion yang dihasilkan. Prinsipnya, makin banyak ion yang dihasilkan, maka semakin kuat sifat elektrolitnya. Larutan jenis.
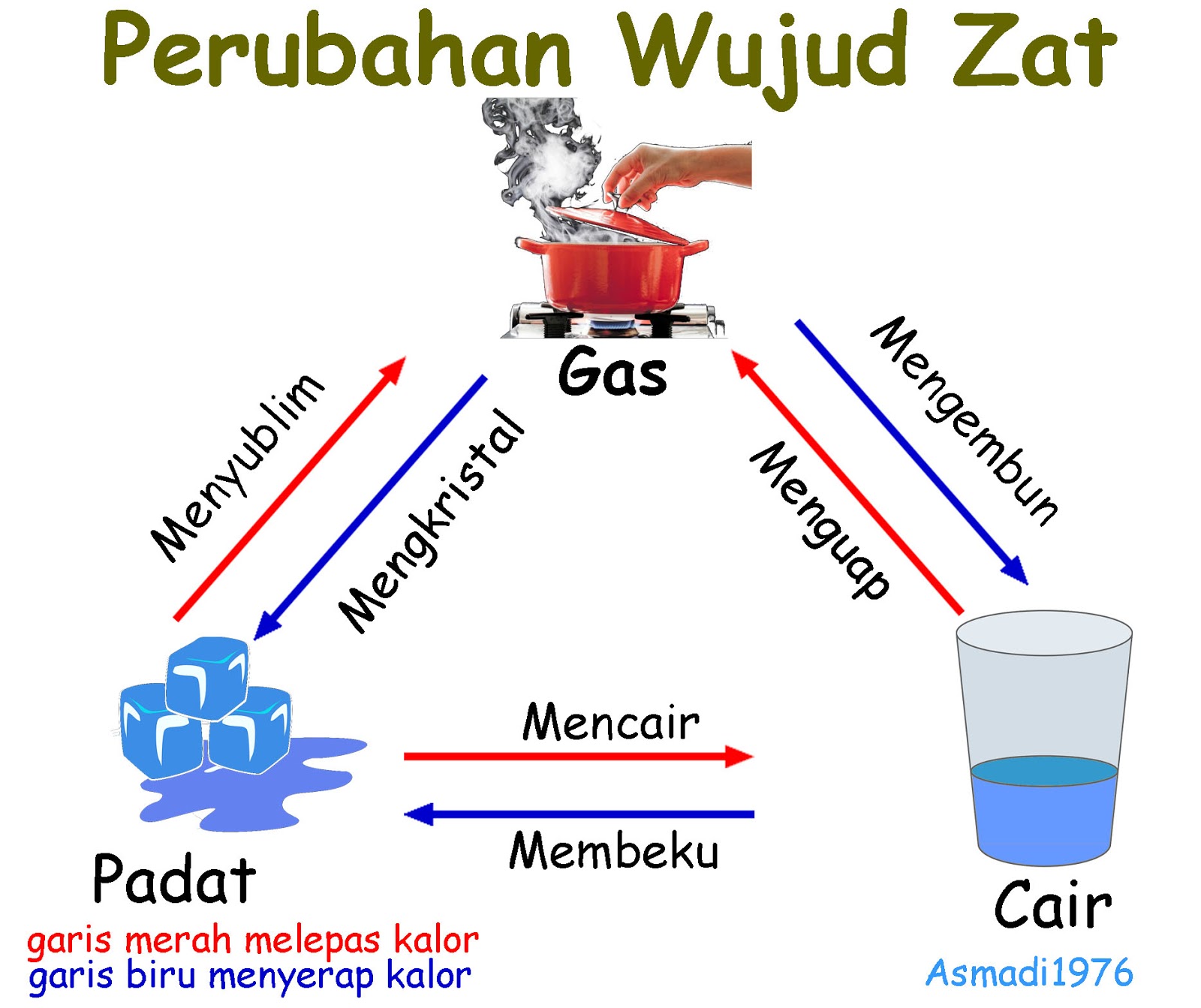
Wujud Zat Ada Berapa
Basa dalam larutan natrium hidroksida serta amonium hidroksida akan menghasilkan banyak ion OH- dan kemudian dapat disebut sebagai basa kuat.. bahwa senyawa asam merupakan senyawa yang dapat melepaskan ion H+ atau ion hydronium H3O+ apabila dilarutkan dalam air. Sedangkan senyawa basa adalah senyawa yang melepaskan ion OH- jika dilarutkan.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Basa merupakan zat yang didalam air dapat melepaskan ion hidroksida (OH -) 2. Konsep Asam dan Basa Bronsted-Lowry. Perkembangan konsep asam dan basa berlanjut pada tahun 1923 ketika Johannes N. Bronsted dan Thomas M. Lowry menyatakan bahwa reaksi asam basa tidak hanya terbatas pada senyawa asam basa dalam pelarut air.

3 contoh senyawa ion kovalen dan logam Alexandra Springer
Berbeda halnya dengan metana (CH4) yang bukan asam Arrhenius karena tidak dapat menghasilkan ion H+ dalam air meskipun memiliki atom H. Disamping itu, basa Arrhenius adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion OH -. Misalnya natrium hidroksida (NaOH) dan ammonium hidroksida (NH 4 OH).

TEORI ASAM BASA ARRHENIUS
Contohnya: Natrium hidroksida = NaOH → Na+ + OH-. Kalium hidroksida = KOH → K+ + OH-. Kalsium hidroksida = Ca (OH)2 → Ca2+ + 2OH-. Dan menurut teori arrhenius NH4OH merupakan senyawa basa karena dapat melepaskan ion OH- dalam larutannya. NH4OH akan terurai sesuai dengan persamaan reaksi berikut: NH4OH ⇌ NH4+ + OH-.
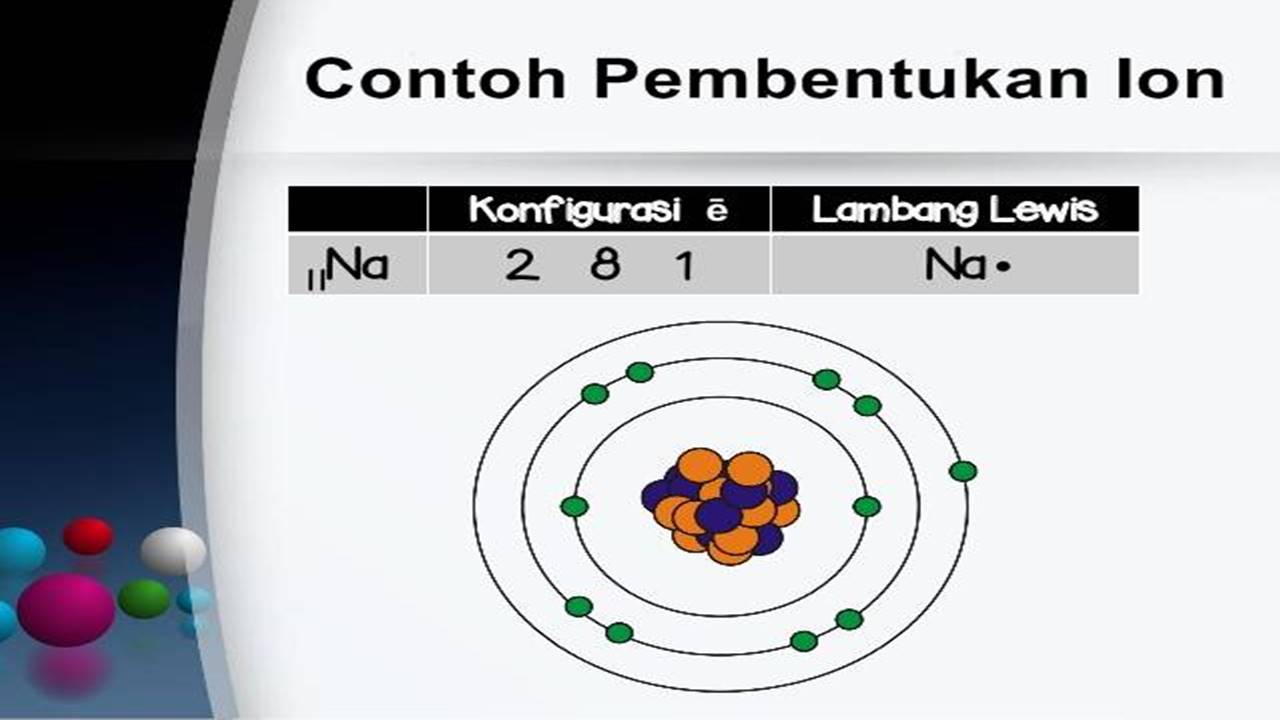
Pembentukan Ion
Dijelaskan dalam Jurnal UNY, teori Arrhenius menyimpulkan: 1. Asam: zat/senyawa yang dapat menghasilkan H+ dalam air. HCl (aq) à H+ (aq) + Cl - (aq) 2. Basa: zat/senyawa yang dapat menghasilkan OH- dalam air. NaOH (aq) à Na+ (aq) + OH - (aq) • Reaksi netralisasi adalah reaksi antara asam dengan basa yang menghasilkan garam:

Di antara zat berikut berikatan ion, sehingga bila zat tersebut dilarutkan dalam air dapat
Teori asam basa yang dikemukakan oleh Svante August Arrhenius pada tahun 1887 ini menyebutkan bahwa bila senyawa elektrolit dilarutkan dalam air maka akan terbentuk ion-ion negatif dan positif. Menurut Arrhenius, suatu senyawa dapat dikatakan asam bila senyawa tersebut dapat melepaskan ion hidrogen dalam air atau yang dapat meningkatkan ion.

Asam adalah zat yang dalam air akan melepaskan ion H+ · PDF fileAsam adalah zat yang dalam
Beberapa zat dapat bertindak sebagai asam, namun juga dapat sebagai basa pada reaksi yang lain, misalnya H 2 O, HCO 3 −, dan H 2 PO 4 −.Zat demikian disebut amfiprotik. Suatu zat amfiprotik (misalnya H 2 O) akan bertindak sebagai asam bila direaksikan dengan zat yang lebih basa darinya (misalnya NH 3) dan bertindak sebagai basa bila direaksikan dengan zat yang lebih asam darinya (misalnya.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Asam kuat adalah asam yang ketika dilarutkan di dalam air bisa melepaskan ion H + dengan mudah. Larutan tersebut bisa mengalami disosiasi total dalam larutan. Sementara basa kuat adalah senyawa basa yang bila dilarutkan dalam air akan melepaskan ion OH - dengan mudah. Sementara itu, asam kuat + basa kuat = netral.
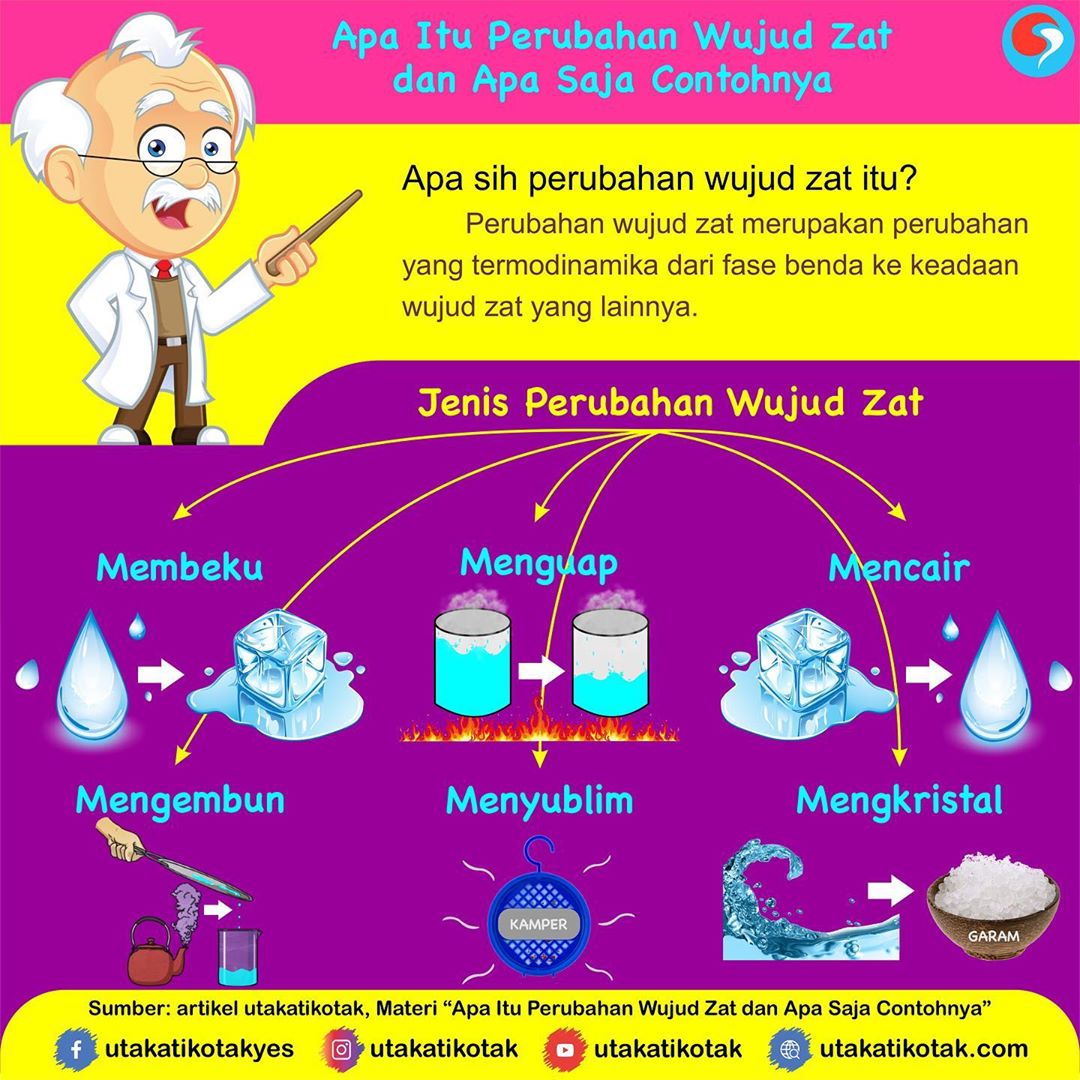
Contoh Perubahan Wujud Zat
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Fathul I'lmi Perpindahan Panas
Ingat ya, ion H+ lho, guys! Asam dirumuskan sebagai HxZ dalam air dan akan mengalami ionisasi sebagai berikut: HxZ → xH+ + Zx. Nah, salah satu contoh zat yang termasuk larutan asam adalah asam sulfat atau H2SO4. Menurut Arrhenius, asam sulfat mempunyai sifat asam karena dapat melepaskan ion H+ dalam air. Sehingga nantinya konsentrasi H+ dalam.