
Tekanan Osmotik ( SIFAT KOLIGATIF) KIMIA SMA YouTube
Rumus Tekanan Osmotik - Assalamualaikum Wr Wb.Alhamdulillah atas izin Alloh SWT serta Ridho dari junjungan Kita Nabi Muhammad SAW, kita dapat berjumpa lagi dalam pembahasan artikel kali ini.. Dimana Edmodo.Id akan membahas materi dengan tema mengenai Tekanan Osmotik yang berdasarkan Pengertian, Penerapan, Rumus, Contoh Soal dan Proses Terjadinya Serta Penjelasannya.
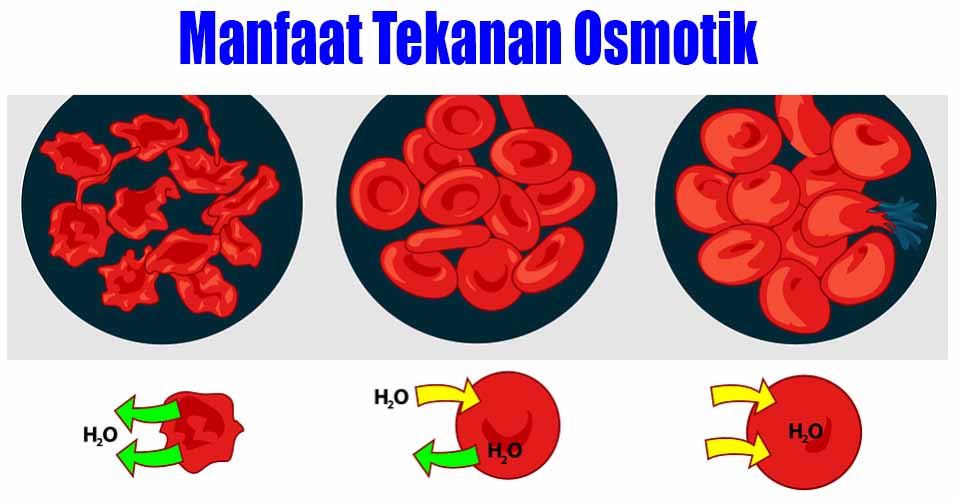
Manfaat Tekanan Osmotik Ilmu Kimia
Nah, untuk mencari tekanan osmotik tersebut, dibutuhkan rumus yang tepat. Menyadur laman Chemistry LibreTexts, berikut rumus dan beberapa contoh soal tekanan osmotik. Keterangan: π = tekanan osmotik (Pa atau atm) M = molaritas (mol zat terlarut perliter) R = konstanta gas (0,082 L atm mol-1 k-1)

Memahami Rumus Tekanan Osmotik dan Contoh Soalnya Varia Katadata.co.id
Keterangan Rumus : ∏ = tekanan osmotik larutan (atmosfir) M = molaritas larutan (mol/L) R = konstanta gas = 0,08205 L atm mol-1 K-1 T = suhu mutlak (°C + 273) K. Dalam hubungannya dengan konsentrasi larutan Van't Hoff menyimpulkan bahwa tekanan osmosis larutan akan semakin besar jika konsentrasi (Molar) dari zat terlarut semakin besar.

Soal dan pembahasan tekanan osmotik
Tentukan tekanan osmotik larutan glukosa 0,03 M pada suhu 29°C. Jawab : π = MxRxT. 0,03M x 0,082 Latm mol/K x (29+273) K. =. 0,74atm. Maka, tekanan osmotik larutan glukosa tersebut yaitu 0,74 atm. Contoh Soal 2. Sebuah larutan terbuat dari 1,14 g sukrosa (C12H22O11) dengan massa molekul relatif 342 yang dilarutkan ke dalam air yang volumenya.

Contoh Soal Tekanan Osmosis (Sifat Koligatif Larutan Non Elektrolit) YouTube
Untuk menjawab rumus ini kita harus mengetahui berapa angka dari masing-masing variable sehingga kita bisa langsung menghitung dan mengetahui berapa besar tekanan osmotik dari larutan ini. Elo sudah mengetahui bahwa R sudah memiliki konstanta yang tetap, yaitu sebesar 0,082, selanjutnya kita mencari suhu, molaritas larutan, dan faktor van't.
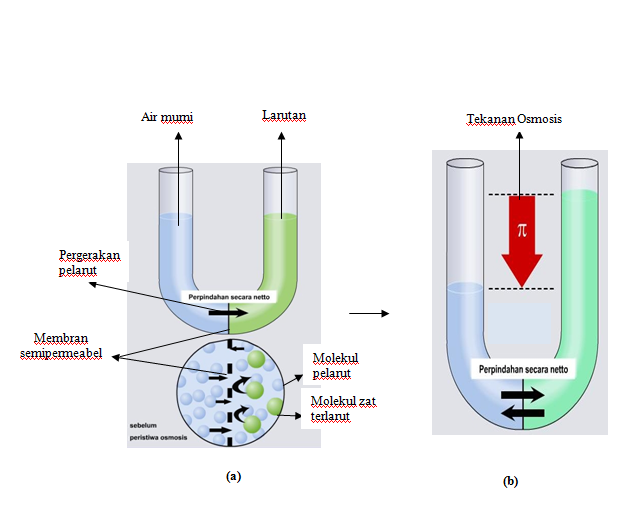
TEKANAN OSMOTIK
Tekanan osmotik dinyatakan dengan rumus: = iMRT (perhatikan bagaimana bentuknya menyerupai PV = nRT dari Hukum Gas Ideal) di mana adalah tekanan osmotikdalam atm i = faktor van 't Hoff zat terlarut M = konsentrasi molar dalam mol/L R = konstanta gas universal = 0,08206 L·atm/mol·K

√ 20 Contoh Soal Tekanan Osmotik Larutan & Pembahasannya PDF
Demikian pembahasan tentang rumus tekanan osmotik atau osmosis yang bisa dipelajari. Ditarik kesimpulan bahwa tekanan osmotik memiliki sifat koligatif, artinya tergantung pada konsentrasi partikel.

Tekanan Osmotik Yang Dihasilkan Oleh Protein Disebut Berkas Soalku
Contoh Soal Tekanan Osmotik. Berikut kumpulan contoh soal tekanan osmotik beserta jawabannya. Soal 1. Tentukan tekanan osmotik larutan glukosa 0,03 M pada suhu 29°C! Jawaban: π = M x R x T = 0,03M x 0,082 Latm mol/K x (29+273) K = 0,74 atm. Jadi, tekanan osmotik larutan glukosa tersebut yaitu 0,74 atm. Soal 2

Soal Dan Pembahasan Tekanan Osmotik Kimia Read Master
Hingga kini, salah satu rumus yang digunakan adalah rumus dari seorang ilmuwan bernama Jacobus Van't Hoff. Dalam rumus tekanan osmotik, ada beberapa kompenen yang dibutuhkan, yakni molaritas, konstanta gas, hingga suhu. Oleh karena itu, sebelum mencari tekanan osmotiknya, pastikan bahwa komponen-komponen yang disebutkan di atas sudah terpenuhi.

Contoh Soal Tekanan Osmotik Elektrolit Dan Jawabannya Blog Sekolah
Tekanan Osmotik: Pengertian - Rumus dan Contoh Soal. Osmotik didefinisikan sebagai aliran bersih atau pergerakan molekul pelarut melalui membran semipermeabel yang tidak dapat dilewati oleh molekul terlarut. Jika larutan penyangga terdiri dari molekul terlarut dan pelarut ditempatkan di satu sisi membran dan pelarut murni ditempatkan di sisi.
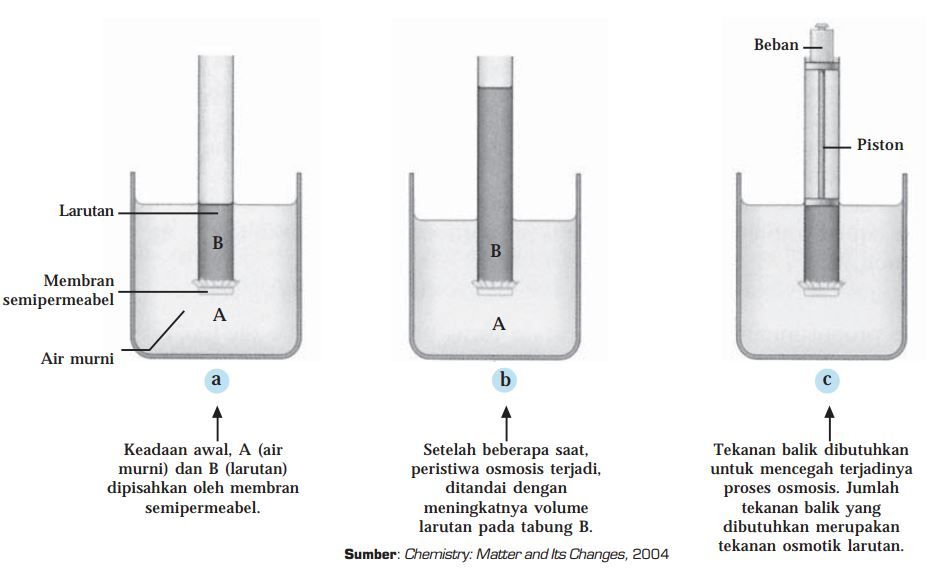
Apa Itu Tekanan Osmotik dan Bagaimana Prosesnya? Kimia Kelas 12 Belajar Gratis di Rumah
Langkah 4: Gunakan rumus untuk menghitung tekanan osmotik. Ketika ada beberapa zat terlarut, tekanan osmotik total sesuai dengan jumlah kontribusi masing-masing. Ini dapat diringkas sebagai berikut: di mana jumlahnya adalah semua zat terlarut yang ada, baik elektrolit maupun non-elektrolit. Hasil dari penjumlahan ini adalah apa yang umumnya.

Apa Itu Tekanan Osmotik dan Bagaimana Prosesnya? Kimia Kelas 12
Pembahasan: Oleh karena perbandingan massa / Mr sama, molaritas akan sama dan tekanan osmotik pun sama. Jadi, tekanan osmotiknya sebesar (A) 2 atm. Nach demikian share materi kimia kali ini mengenai Rumus dan Contoh Soal Tekanan Osmotik Larutan Elektrolit. Semoga materi kimia di atas dapat memberikan manfaat bagi kita semua.

Contoh Soal Tekanan Osmotik Elektrolit Dan Jawabannya Blog Sekolah
Rumus lain untuk menghitung tekanan osmotik adalah π = n/VRT dengan V adalah volume air. Baca Juga: Pengertian Sifat Koligatif Larutan beserta Rumus dan Contoh Soal Contoh soal tekanan osmotik Contoh 1. Satu mol garam meja dilarutkan ke dalam air dengan volume satu liter.

Rumus Tekanan Osmotik Beserta Pengertian dan C
Rumus Tekanan Osmotik beserta Contoh Soal dan Pembahasannya. Menyajikan informasi terkini, terbaru dan terupdate mulai dari politik, bisnis, selebriti, lifestyle dan masih banyak lagi. Ilustrasi larutan yang dapat dihitung tekanan osmotiknya. Foto: Pixabay. Larutan memiliki sifat koligatif yang hanya dipengaruhi oleh jumlah partikel zat terlarut.

Tekanan Osmosis (Pengertian, Rumus, Proses Terjadi, dan Contohnya)
Tekanan osmotik akan mempertahankan kesetimbangan osmotik pada larutan A dan B. Namun, kondisi pada gambar (b) bisa dikembalikan lagi ke keadaan awal seperti pada gambar (a). Caranya adalah dengan memberikan tekanan luar yang besarnya sama dengan tekanan osmotiknya, seperti terlihat pada gambar (c). Nah, setelah memahami apa itu tekanan osmotik.

Contoh Soal Tekanan Osmosis Mencari Mr (Sifat Koligatif Larutan Elektrolit) YouTube
Karena tekanan osmotik dilambangkan dengan , maka kita dapat menuliskan rumus persamaan tekanan osmotik yaitu. = M x R x T. Atau untuk larutan elektrolit yaitu. = M x R x T x i. Dalam hal ini, i merupakan faktor Van't Hoff yang dimiliki oleh suatu larutan elektrolit. Faktor Van't Hoff dapat dirumuskan sebagai berikut. i = 1 + (n-1)