
Menghitung Molaritas Bab Sifat Koligatif Larutan YouTube
Pengertian molalitas. Dilansir dari Chemistry LibreTexts, molalitas adalah cara menyatakan konsentrasi larutan. Molalitas merupakan jumlah mol suatu zat terlarut dalam satu kilogram atau 1.000 gram pelarut. Tidak seperti molaritas yang bergantung pada ukuran liter larutan, molalitas bergantung pada massa larutan.
Pahami Rumus Molaritas, Contoh Soal, dan Pembahasannya Berikut Ini
Rumus Molaritas. Molaritas termasuk konsentrasi larutan. Dari berbagai bentuk konsentrasi yang dipengaruhi sifat koligatif larutan yaitu molaritas, molalitas, dan fraksi mol. Satuan molaritas adalah mol/liter atau M. Rumus molaritas yaitu mol zat terlarut dibagi volume larutan. Tetapi, molaritas dapat dicari melalui massa jenis zat terlarut dan volume larutan.

Pengertian Molaritas, Rumus dan Contohnya
Postingan ini membahas contoh soal molaritas dan pembahasannya. Molaritas adalah salah satu cara menyatakan konsentrasi atau kepekatan larutan. Molaritas menyatakan jumlah mol zat terlarut dalam tiap liter larutan. Satuan Molaritas adalah mol/liter atau mmol/mL. Rumus molaritas Rumus yang digunakan untuk menghitung atau menentukan molaritas sebagai berikut: M = n V Jika yang akan dicari.

Cara mudah mencari molaritas pada reaksi kimia SMA YouTube
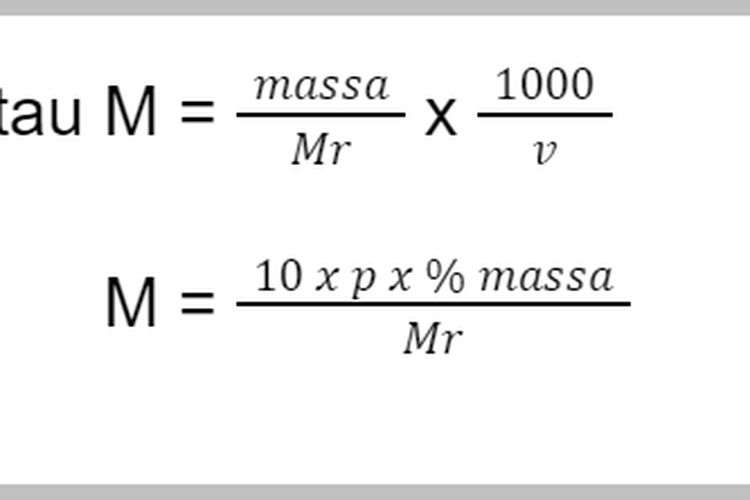
Hubungan Molaritas dengan Kadar Larutan (Persentase Kepekatan Zat)

Pengertian Dan Rumus Molaritas Dan Contoh Soal Molaritas Lengkap Riset Riset
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.

Kimia kelas 10 semester 2 stoikiometri Mencari molaritas berdasarkan persen dan massa jenis
Mencari molaritas mengharuskanmu mengetahui jumlah mol dan banyaknya liter. Jika kamu tidak mengetahui jumlah mol, tetapi mengetahui volume dan massa larutan, kamu harus menggunakan dua hal ini untuk menghitung jumlah mol sebelum melanjutkan. Contoh soal: Massa = 3,4 g KMnO 4;

Rumus Mencari Molaritas dari Kadar Larutan (Persentase Kepekatan Zat) YouTube
2. Molaritas NH 3. Dari perhitungan di atas, didapatkan molalitas dan molaritas NH 3 masing-masing sebesar 25,2 mol/kg dan 32,3 mol/L. Contoh Soal 4. Diketahui sebuah Molaritas dari Larutan NaCl sebesar 0,4 M pada air sebanyak 40 L tentukan banyak mol NaCl yang terlarut pada Air tersebut. Pembahasan: Diketauhi: Molaritas = 0,4 M V = 40 L

Molaritas Cara mencari pertambahan volume air pada Molaritas YouTube
Maka, cara mencari molaritas jika diketahui volume-nya adalah sebagai berikut: M = 0,106/0,125 = 0,85 Jadi, molaritas larutannya yaitu 0,85 M. Itu tadi penjelasan mengenai molaritas yang menggambarkan hubungan antara mol zat terlarut dan volume larutan, beserta rumus molaritas lengkap dengan pembahasan soalnya.

Rumus Molaritas Yang Ada Massa Jenis Edukasi Lif Co Id My XXX Hot Girl
Pengertian Molaritas. Sebelum masuk ke rumus molaritas dan contoh soal, elo harus mengetahui dasarnya dulu tentang apa itu molaritas. Molaritas adalah salah satu ukuran kelarutan yang menyatakan jumlah mol suatu zat per volume larutan. Molaritas ini dilambangkan dengan huruf "M" dengan satuannya molar atau M yang setara dengan mol/liter.

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Terdapat beberapa rumus molaritas yang dapat kita gunakan, tentunya bergantung pada jenis soal yang kita jumpai. 1. Rumus Molaritas Dasar. Rumus molaritas yang paling dasar secara matematis dirumuskan sebagai berikut : M =. n V. Keterangan: M menyatakan Molaritas. Satuan dari Molaritas adalah : mol/liter.

Contoh soal MOLARITAS YouTube
Rumus normalitas kimia adalah N = n x a /V, yang menyatakan nilai normal (N) yang sama dengan satu mol ekivalen/liter. Dalam kimia, terdapat beberapa besaran yang dapat digunakan untuk menyatakan suatu konsentrasi zat terlarut dalam sebuah larutan antara lain yaitu molaritas, molalitas, normalitas dan fraksi mol.

Cara mudah mencari molaritas pada titrasi asam dan basa kimia SMA YouTube
Jadi, fraksi mol masing - masing adalah : X A = 0,25. X B = 0,5. X C = 0,25. Dari ketiga fraksi mol di atas, jika dijumlahkan harus menghasilkan 1 sesuai rumus : X A + X B + X C = 1. 0,25 + 0,5 + 0,25 = 1. Demikian pembahasan dari kami, semoga bermanfaat dan menambah wawasan serta pengetahuan kalian. Sekian terima kasih.

apa perbedaan molalitas dan molaritas Brainly.co.id
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

Untuk menentukan molaritas larutan H2 SO4 dilakukan den...
Rumus untuk molaritas hanyalah konversi dari ekspresi di atas. Massa / volume = molaritas * massa molar, setelah itu massa / (volume * massa molar) = molaritas. Substitusikan semua nilai yang diketahui untuk perhitungan molaritas: molaritas = 5 / (1,2 * 36,46) = 0,114 mol/l = 0,114 M. Anda juga dapat menggunakan kalkulator molaritas untuk.

Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol YouTube
Dilihat dari soal, bisa diketahui bahwa volume zatnya berbentuk liter, maka cara mencari molaritas adalah dengan menggunakan rumus: Namun, sebelum itu kamu harus mencari nilai banyaknya mol zat terlarut (n) yang dalam hal ini adalah nilai NaOH. Rumusnya adalah n = gram/Mr. Zat terlarut NaOH 10 gram = 10/40 = 0,25 mol. Volume larutan = 2 liter

Pengertian Rumus Dan Contoh Soal Mol Molalitas Molaritas Dan Riset My XXX Hot Girl
Molaritas larutan urea bisa dihitung dengan cara : Jumlah mol urea, n = gram/Mr = 3/60 = 0,05 mol Molaritas larutan, M = n/V = 0,05/0,25 = 0,2 molar Maka molaritas larutan urea yaitu 0,2 molar atau 0,2 mol/liter. Contoh perhitungan molalitas larutan. Misalnya 10 gram natrium hidroksida (NaOH) dilarutkan dalam 2 kg air. Massa molekul relatif.