
Ikatan Ion Beserta Contoh Ikatannya Rumus Kimia
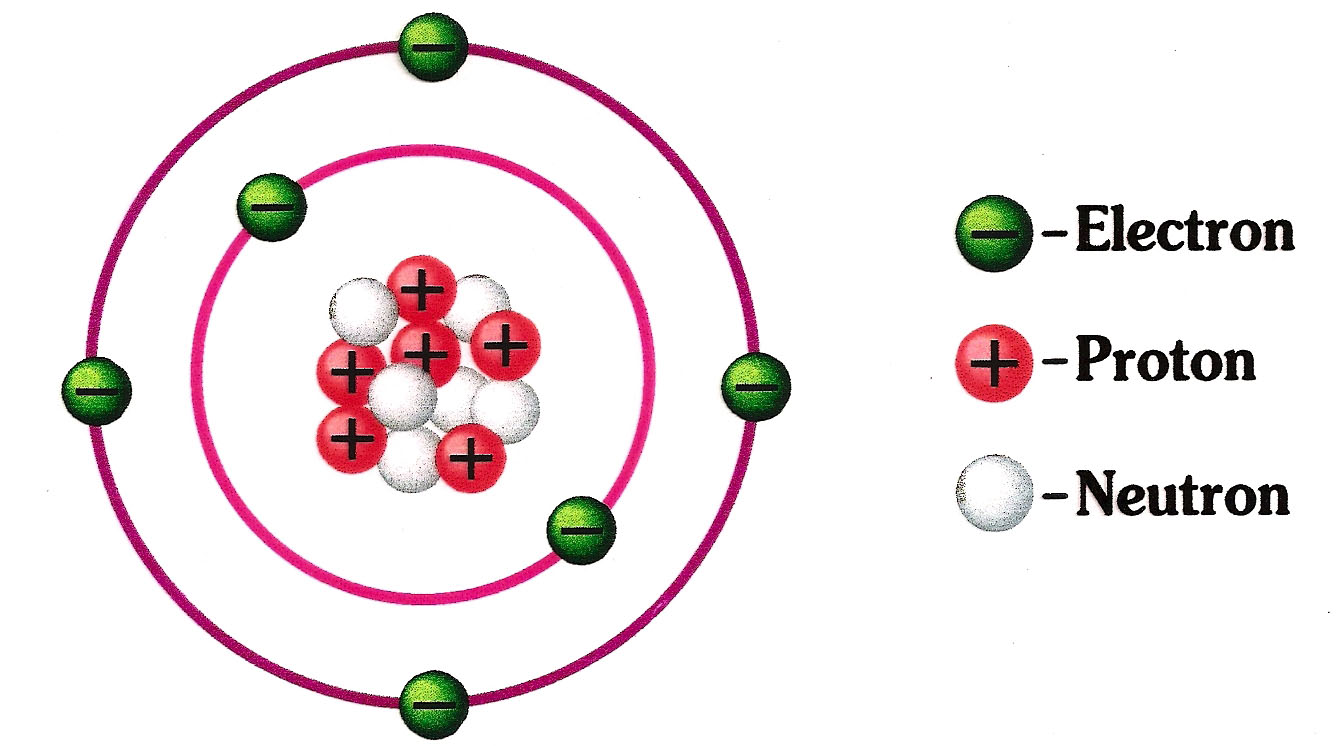
Kestabilan ini bisa didapatkan dengan cara mendapatkan atau melepas elektron. Menurut Kossel dan Lewis, kestabilan atom ditentukan berdasarkan susunan atau konfigurasi elektron. Konfigurasi elektron akan stabil jika elektron terluarnya 2 (duplet) atau 8 (oktet). Hanya gas mulia yang memiliki konfigurasi elektron seperti ini.
Struktur Atom Pengertian Rumus Dan Contoh Soal Dalam Kimia Jumankera Sexiz Pix
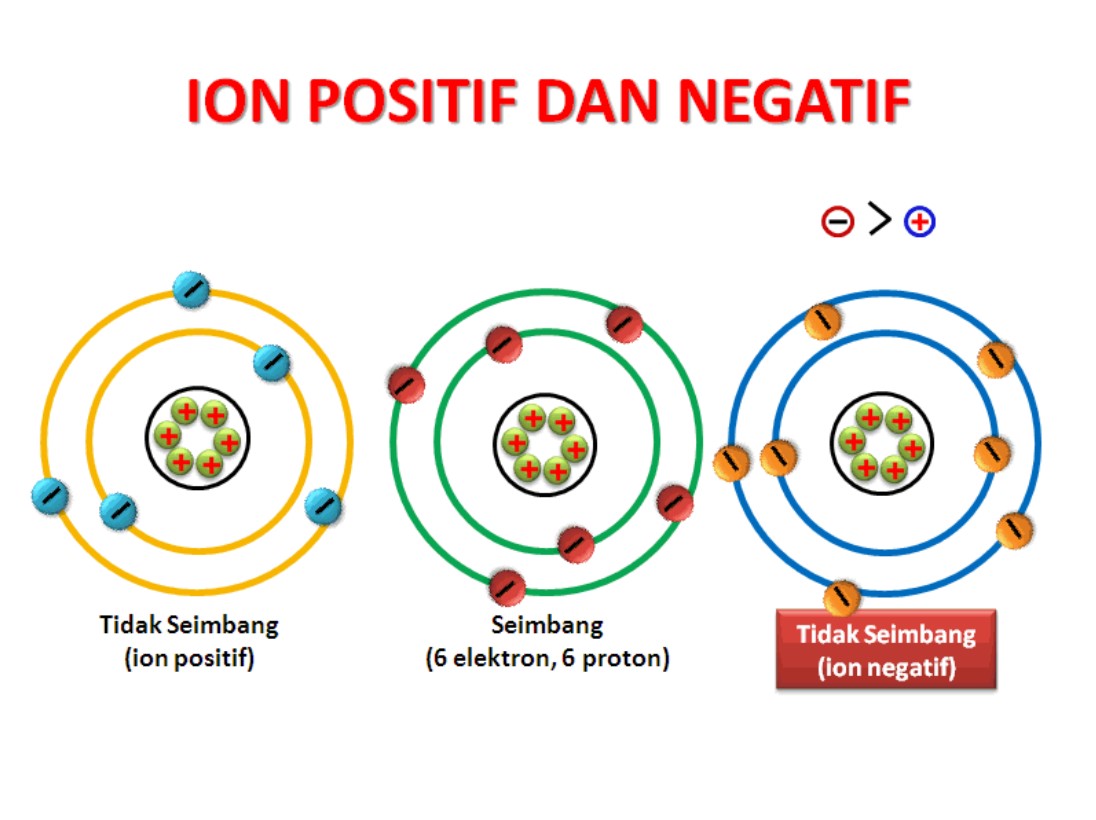
Pelepasan elektron menghasilkan ion positif dan penyerapan elektron menghasilkan ion negatif. Peristiwa terlepas atau masuknya ion pada sebuah atom disebut ionisasi . Contohnya, ketika atom natrium (Na) melepas satu elektron, maka akan membentuk ion Na + , atau ketika atom klorin (Cl) menerima 1 elektron, maka akan membentuk ion Cl - .

Trik Super Kilat Memahami Keelektronegatifan
Pada kenyataannya, Reaksi Reduksi Oksidasi melepas dan menerima elektron berlangsung secara bersamaan. Ketika sebuah zat mengalami oksidasi dengan cara melepaskan elektron, zat lain dalam reaksi akan menerima elektron tersebut sehingga mengalami reduksi. Contoh Konsep Pelepasan dan Penerimaan Elektron Reaksi Redoks: 1.

Lihatlah Gambar Berikut Gambar Yang Menunjukkan Aliran Elektron Adalah serat
HNO 3 adalah asam.HNO 3 melepas proton (H+) menjadi NO 3 - yang merupakan basa konjugasi. H 2 O adalah basa.H 2 O menerima proton (H+) menjadi H 3 O + yang merupakan asam konjugasi.. Maka, HNO 3 dan NO 3 - merupakan pasangan asam basa konjugasi. Serta, H 2 O dan H 3 O + merupakan pasangan asam basa konjugasi. [inline_ads] 3. Zat Amfoter. Zat amfoter adalah suatu zat yang berperan sebagai.
Sifat Keperiodikan Unsur Titik Leleh Dan Titik Didih Berbagai Unsur
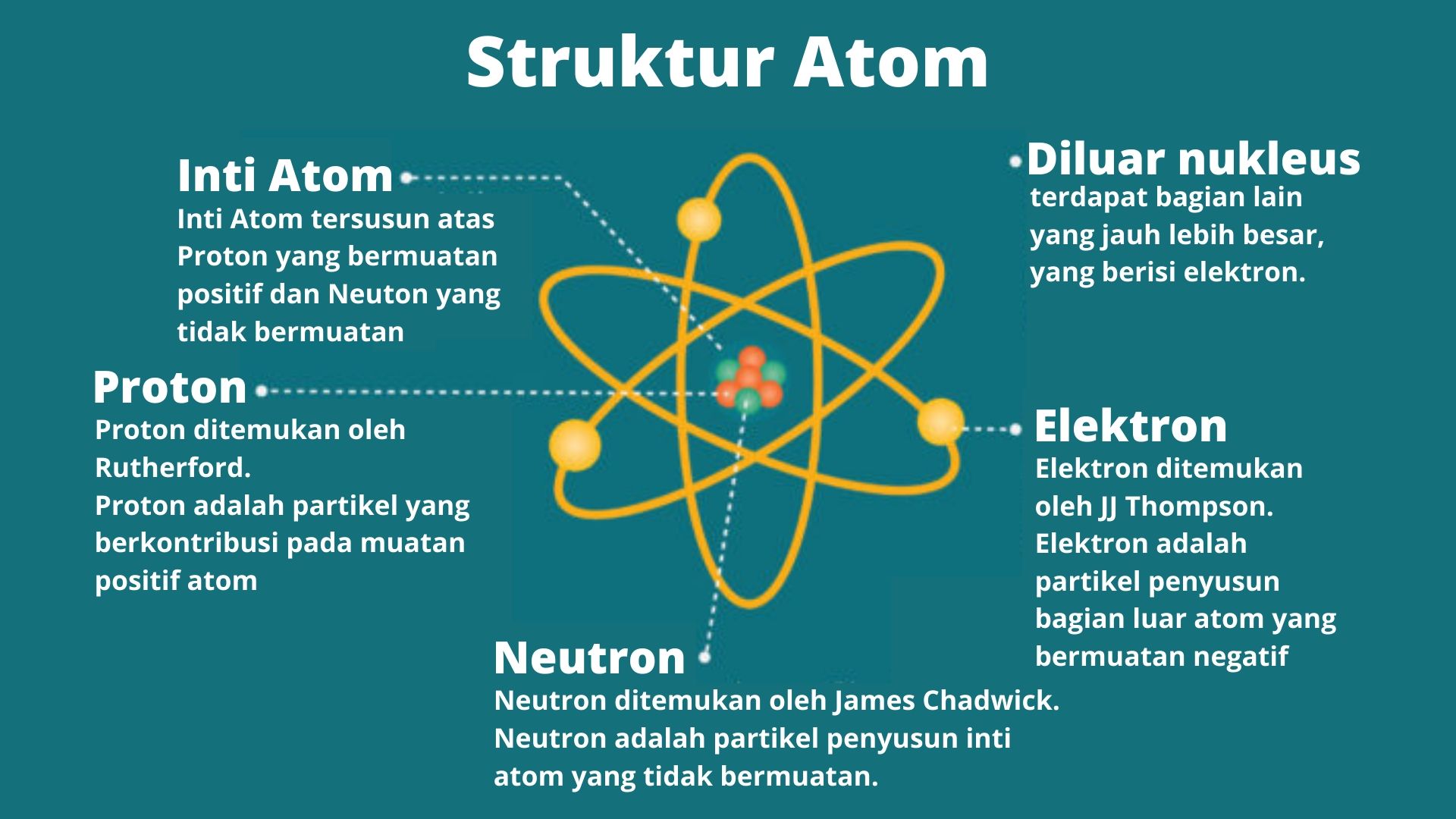
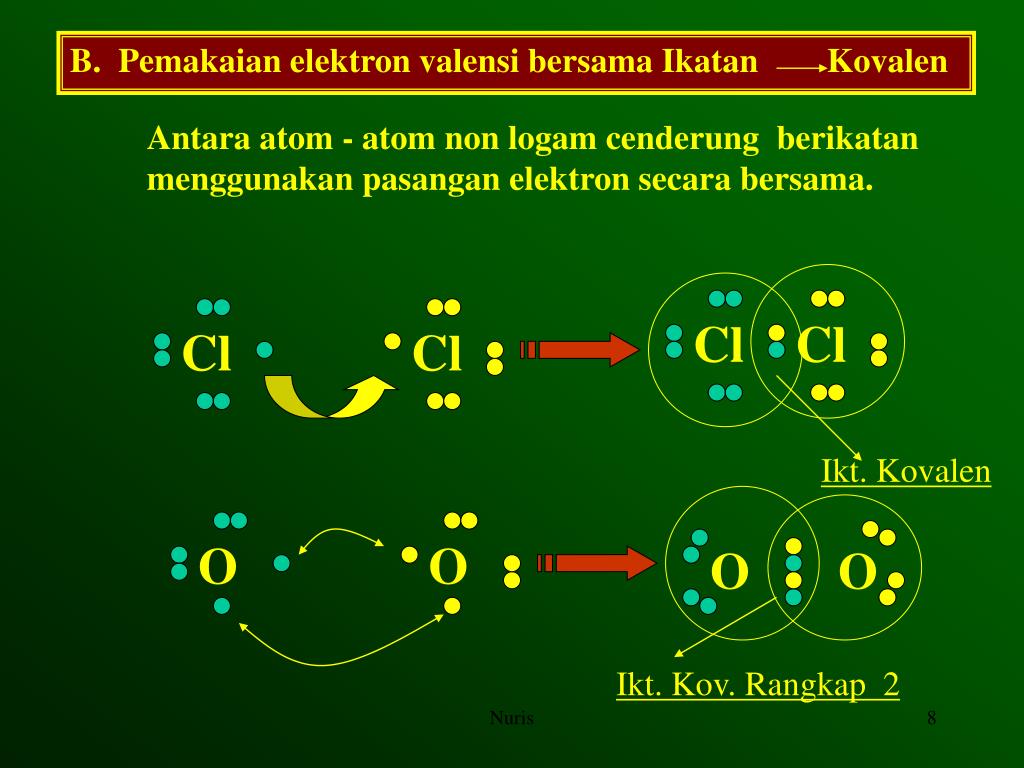
Terbentuknya ikatan kimia antar unsur terjadi karena adanya interaksi antar unsur yang saling melepas dan menerima elektron valensi atau membentuk pasangan elektron bersama. Gambaran terbentuknya ikatan kimia digambarkan dengan notasi yang disebut Struktur Lewis. Struktur Lewis dilambangkan dengan memberikan titik (.) atau silang (x) di sekitar lambang atom.

Cara Konfigurasi Elektron Anion Fluor "9F" (Cara Mekanika Kuantum) YouTube
Untuk mencapai kestabilan, suatu unsur dapat melepas dan menerima elektron pada kulit terluarnya melalui pembentukan ikatan kimia. dengan menggambarkan struktur lewisnya. Atom yang berikatan akan menggunakan elektron vasensinya masing-masing, sehingga berikatan menjadi susunan yang sempurna atau stabil dan memenuhi kaidah oktet.

Prinsip Pembentukan Molekul dan Ion Ion dan Ikatan Ion, IPA Kelas 9 SMP Halaman 1 Kids
Yuk, pelajari konsep dasar reaksi redoks (reduksi-oksidasi) berdasarkan pelepasan dan pengikatan oksigen, perpindahan (transfer) elektron, dan perubahan bilangan oksidasi (biloks) dengan membaca artikel berikut! Di kehidupan sehari-hari, kita banyak menemukan fenomena-fenomena yang melibatkan reaksi kimia.

PPT Materi Minggu ke3 IKATAN KIMIA PowerPoint Presentation, free download ID7082311
transfer elektron serta perubahan bilangan oksidasi (Brady dan Jespersen, 2012). Ketiga konsep redoks ini merupakan konsep yang saling berhubungan. Ketiganya merupakan proses yang berpasangan dimana ada yang melepas dan ada yang menerima, serta melibatkan perubahan kimia dimana jumlah unsur/elektron yang

Atom,ion dan molekul
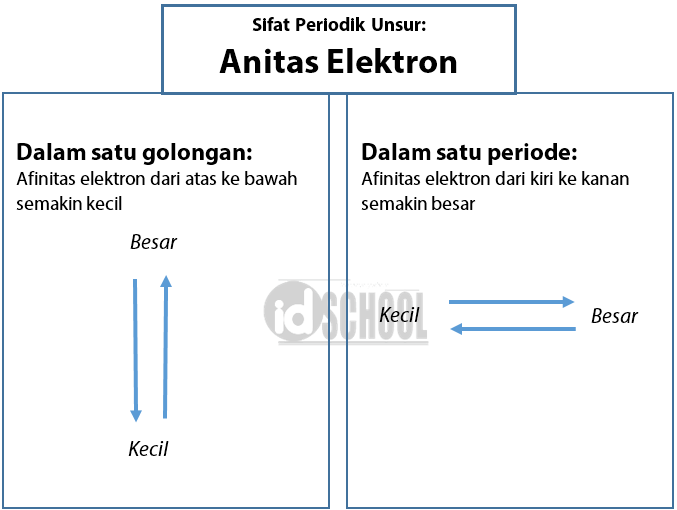
melepas dan menerima elektron Berdasarkan sifatnya, dalam sifat keperiodikan unsur, unsur atau atom dapat dibagi menjadi 3, yaitu unsur logam dan non logam serta metalloid.
Ikatan Kimia Pengertian Jenis Sifat Fisis Chem Sci Com Sexiz Pix
Sebagian atom cukup sulit melepas dan menerima elektron, untuk itu mereka perlu energi besar untuk memprosesnya. Maka terbentuklah konfigurasi elektron dimana atom saling berikatan lewat pemakaian pasangan elektron bersama yang terjadi pada atom nonlogam. Ikatan tersebut yang kita kenal dengan ikatan kovalen.

Unsur yang Paling Mudah Melepas Elektron YouTube
Pembahasan. Atom logam cenderung melepaskan elektron karena memiliki energi ionisasi yang kecil, sementara atom nonlogam cenderung menerima elektron karena memiliki afinitas elektron yang besar. Kecenderungan atom melepaskan atau menerima elektron dipengaruhi energi ionisasi dan afinitias elektron atom tersebut.
Pengertian Teori Elektron dalam Pembelajaran Elektronika ULBE Ulasan Lengkap Belajar Elektronika
2Na → 2Na + + 2e - (oksidasi) Cl 2 + 2e - → 2Cl - (reduksi) Jadi jumlah transfer elektron atau perubahan bilangan oksidasi yang terjadi pada reaksi tersebut sama dengan 2. Pada contoh-2, jumlah elektron yang dilepas H 2 = 2, dan jumlah elektron yang diterima O 2 = 4, tampak bahwa jumlah elektron yang dilepas tidak sama dengan jumlah.

Kelemahan Dan Kelebihan Model Atom Mekanika Kuantum Seputar Model
Maksudnya, ada zat yang melepas elektron dan ada yang menerima elektron di dalam sebuah reaksi redoks. Karena itulah nama reaksinya adalah reaksi reduksi-oksidasi atau reaksi redoks. Rumus umum reaksi redoks berdasarkan transfer elektron adalah sebagai berikut: A → An+ + n e (oksidasi) An+ + n e → A (reduksi)
PPT IKATAN KIMIA PowerPoint Presentation, free download ID5631507
Saat kulit elektron terluar terisi penuh, unsur tersebut akan sulit untuk melepas maupun menerima elektron dari lingkungan sehingga stabil dan tidak mudah bereaksi. Baca juga: Menghitung Reaksi antara Asam Nitrat dan Gas Amonia . Untuk atom yang memiliki elektron valensi lebih atau kurang dari 8, maka atom tersebut akan berikatan dengan atom lain.

Soal Sma X Melepas Dan Menerima Elektron Plus Atau Minus 2 Q2 = 12μc = 12 x 10−6 c
Pembentukan Natrium klorida (khanacademy.org) Na kelebihan 1 elektron untuk menjadi 8, sedangkan Cl kekurangan 1 elektron untuk menjadi 8. Sehingga Na melepaskan 1 elektronnya dan berubah menjadi kation. Lalu 1 elektron tersebut ditangkap oleh Cl, sehingga Cl berubah menjadi anion. Terbentuklah ikatan ionic molekul NaCl antara ion Na+ dan Cl-.
√ Apabila Suatu Unsur Melepas Elektron Maka Wanjay
Pembahasan. Kecenderungan suatu atom untuk melepaskan elektron dapat dilihat dari nilai energi ionisasinya. Energi ionisasi (EI) adalah energi yang dibutuhkan untuk melepaskan 1 elektron dalam keadaan gas. Nilai energi ionisasi dapat dipengaruhi oleh nomor atom. Bertambahnya nomor atom dalam satu periode dari kiri ke kanan menunjukkan semakin.