
Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
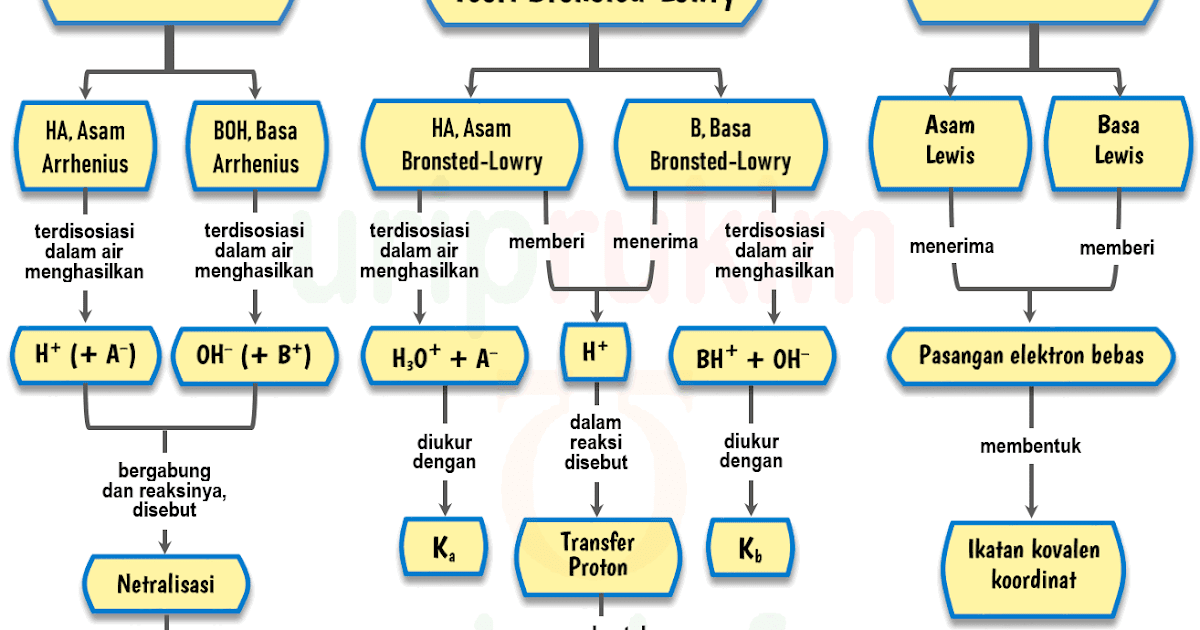
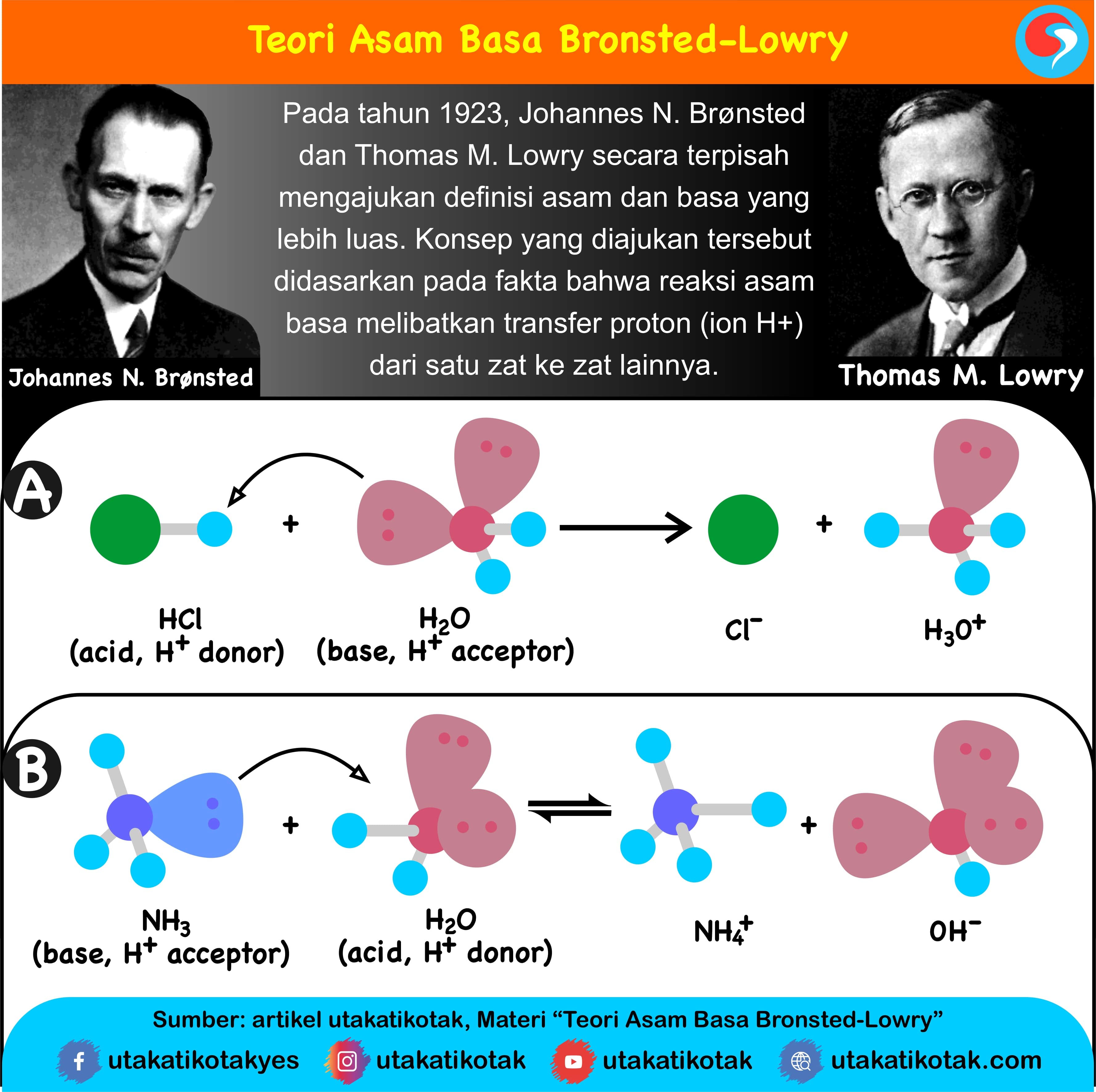
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.
Get Contoh Soal Asam Basa Menurut Arrhenius Gif
2. Teori Asam Basa Arrhenius. Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -.

TEORI ASAM BASA ARRHENIUS
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.

Konsep Asam Basa kimia A. Konsep Asam Basa Teori Asam Basa a. Teori Arrhenius Menurut
Dengan kata lain, amonia bertindak sebagai basa dengan cara menerima satu ion hidrogen dari asam. Karena proton selalu dihasilkan menurut teori asam-basa Arrhenius, berarti semua reaksi asam-basa Arrhenius merupakan reaksi asam-basa Bronsted-Lowry, dengan catatan, air terlibat dalam reaksi.

Teori Asam Basa
Karakteristik Asam Menurut Teori Arrhenius. Menurut teori Arrhenius, terdapat beberapa karakteristik yang dapat mengidentifikasi asam. Berikut adalah beberapa ciri-ciri asam menurut teori ini: 1. Rasa Asam. Asam memiliki rasa asam yang khas. Contohnya, asam sitrat yang terdapat dalam buah lemon memberikan sensasi asam yang segar saat dikonsumsi. 2.

Teori Asam Dan Basa Menurut Arrhenius Sexiz Pix
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.

TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

diantara senyawa berikut yang bersifat asam menurut Arrhenius adalah YouTube
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan basa adalah zat yang.

Asam Basa Arrhenius Bagian 1 (Definisi Asam Basa) Materi Larutan Asam Basa Kimia SMA Pojan
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Teori Asam Basa
Teori Asam Basa Menurut Ahli. Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya. Teori Asam Basa Arrhenius. Svante Arrhenius adalah seorang ilmuwan asal Swedia yang telah berhasil mengemukakan teori asam dan basa pada tahun.

Definisi Asam Menurut Arrhenius Adalah
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam.

Teori Asam Basa Menurut Arrhenius Your Chemistry A Sexiz Pix
Pembahasan. Menurut Arrhenius, asam adalah senyawa yang menghasilkan ion dalam air, sedangkan basa senyawa yang menghasilkan ion dalam air. Perkembangan teori asam basa dimulai dari seorang tokoh bernama Svante Arrhenius (1859-1927). Beliau mengemukakan teori asam-basa untuk larutan dengan pelarut air.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
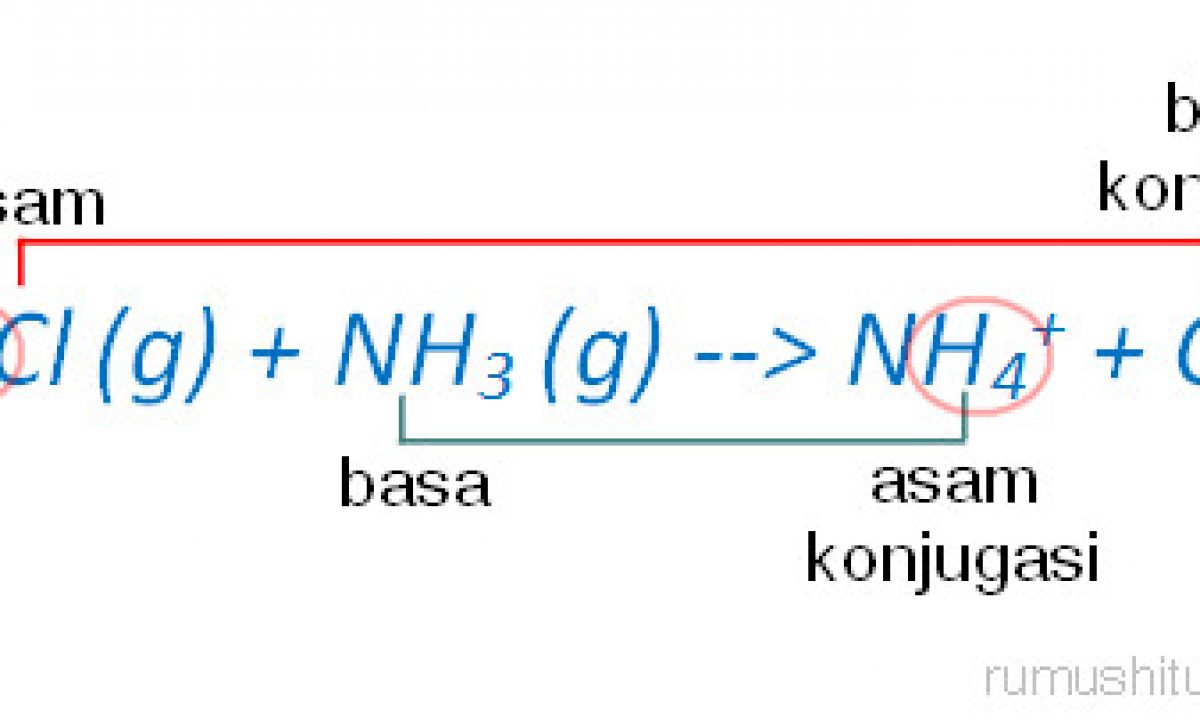
Rumusan umum untuk reaksi asam-basa menurut definisi Brønsted-Lowry adalah: HA + B → BH + + A −. dalam reaksi di atas, HA mewakili asam, B mewakili basa, BH + mewakili asam konjugasi dari B, dan A − mewakili basa konjugasi dari HA. Air bersifat amfoterik—yaitu, ia dapat bertindak sebagai asam dan basa.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Pengertian Asam Menurut Arrhenius. Dalam ilmu kimia, asam adalah salah satu jenis senyawa kimia yang memiliki sifat-sifat khas. Menurut teori Arrhenius, asam adalah senyawa kimia yang dapat membebaskan ion hidrogen (H+) ketika larut dalam air. Teori ini dikemukakan oleh ahli kimia Swedia bernama Svante Arrhenius pada akhir abad ke-19.