
PENGERTIAN REDOKS DAN CARA MENCARI BILOKS YouTube
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4 {2-} or NH2NH3 {+}. Enter just an element symbol to show the common and uncommon oxidation states of the element. Use uppercase for the first character in the.

OralB iO Series 3 Limited Electric Toothbrush with (2) Brush Heads, Rechargeable, ICY Blue
Menyetarakan atom yang mengalami perubahan biloks Cl₂ + IO₃⁻ → 2Cl⁻ + IO₄⁻ 4. Menentukan jumlah perubahan biloks Cl₂ = 0 berubah ke 2Cl⁻ = -2, biloks Cl berubah 2 angka I pada IO₃⁻ = + 5 berubah ke I pada IO₄⁻ = +7, biloks I berubah 2 angka Karena perubahan biloks sama - sama 2 maka tidak perlu disetarakan 5.
OralB iO3 Review Electric Teeth
Ingat aturan biloks nomor 5, jumlah bilangan oksidasi unsur yang membentuk ion akan sama dengan jumlah muatannya. Jadi, biloks Cr dan O apabila dijumlah, hasilnya harus -2. Cr 2 O 7 2-Biloks O = -2. Karena atom O memiliki indeks 7, maka biloks O dikalikan dengan indeks O = -2 x 7 = -14. Agar jumlah biloks Cr dan O = -2, maka biloks Cr harus.

Cara Simpel Menentukan Biloks Unsur YouTube
Reaksi reduksi ditandai dengan pelepasan oksigen atau pengikatan hidrogen, penurunan biloks, dan pengikatan elektron. Sedangkan reaksi oksidasi ditandai dengan pengikatan oksigen atau pelepasan hidrogen, kenaikan biloks, dan pelepasan elektron. Untuk menentukan biloks unsur pada soal ini berlaku aturan yaitu: biloks unsur halogen umumnya = 1

Penyetaraan Reaksi Redoks Metode Biloks Pada Kondisi Asam 3 YouTube
Selasa, 07 September 2021. Setarakan persamaan reaksi redoks berikut untuk suasana asam dan suasana basa dengan menggunakan metode perubahan bilangan oksidasi (metode PBO). Cr2O72- + I- → Cr3+ + I2. Menghitung bilangan oksidasi (biloks) rata-rata atau biloks setiap satu atom. Menyetarakan jumlah atom yang mengalami perubahan biloks dan.

Bilangan Oksidasi Kimia (Biloks) Tabel Biloks, Contoh Soal dan Jawaban
Hallo Yolanda, izin bantu jawab ya :) Langkah I Tentukan oksidasi dan reduksi dengan mengunakan cara berikut : OKSIDASI Ι-----Ι Cl₂ + IO₃⁻ ⇒ Cl⁻ + IO₄⁻ 0 +5 -2 -1 +7 -2 Ι-----Ι REDUKSI Langkah II Setarakan reaksi dengan menggunakan cara setengah reaksi sebagai berikut : Langkah 1 : Untuk mempermudah maka buatlah zat yang mengalami oksidasi dan reduksi sebagai berikut.

PACIFIC INTERNATIONAL LINES (PIL) CHOOSES iO3’S JARVISS SOLUTION AS PART OF DIGITALISATION STRATEGY
Hasil Akhir 2MnO + 5PbO 2 + 8H + → 2MnO 4-+ 5Pb 2+ + 4 H 2 O. 1. Sifat koligatif larutan adalah sifat larutan yang (A) memperhitungkan macam dan jumlah zat yang terlarut (B) memperhitungkan macam zat terlarut saja (C) tidak memperhitungkan macam dan jumlah zat yang terlarut (D) hanya memperhitungkan jumlah mol zat yang terlarut (E) kadang-kadang memperhitungkan jumlah mol zat terlarut.

biloks Cu biloks kimia kelas X YouTube
halo keren pada saat kali ini kita diminta untuk menyetarakan reaksi redoks menggunakan cara setengah reaksi pada suasana asam berarti Bagaimana langkah-langkah penyetaraan reaksi redoks menggunakan metode setengah reaksi pada suasana asam yang pertama identifikasi substansi yang mengalami oksidasi dan reduksi dimana reaksinya adalah io3 Min Plus no2 menjadi I2 + no3 Min cara paling mudah.

PENENTUAN BILANGAN OKSIDASI (BILOKS). YouTube
Sehingga hasil akhirnya menjadi: 3P + 5 NO3− + 4OH− 3PO4 3− + 5NO + 2H2O. Semoga dari penjelasan materi kali ini, sahabat bisakimia dapat memahami lebih baik lagi tentang metode biloks dalam penyetaraan persamaan reaksi redoks. Nantikan update pembahasan soal lainnya disini. Semoga bermanfaat untuk teman-teman semua.

OralB iO3 Review Electric Teeth
Penyetaraan Reaksi Redoks Metode Bilangan Oksidasi Dalam Suasana Asam - Basa.Penyetaraan Reaksi Redoks MnO4- + Cl- Metode Biloks Suasana Asamhttps://youtu.be.

Metode PBO, Penyetaraan 10 Cl2 + IO3 → 2Cl + IO4 (suasana basa) YouTube
Halo kok offline bilangan oksidasi I didalam ion io3 Min adalah untuk mengetahui biloksnya kita dapat melihat aturan umum bilangan oksidasi sebagai berikut maka untuk biloks ion io3 Min adalah biloks o dapat dilihat di aturan nomor 6 yaitu min 2 min 2 x dengan 3 adalah min 6 selanjutnya kita lihat aturan nomor 3 yaitu jumlah biloks dalam ion poliatom sama dengan muatan ion nya muatan ion.

IO3 Lewis Structure How to Draw the Lewis Structure for the Iodate Ion YouTube
Solution. Step 1: Separate the half-reactions. By searching for the reduction potential, one can find two separate reactions: Cu+(aq) +e− → Cu(s) and. Fe3+(aq) + 3e− → Fe(s) The copper reaction has a higher potential and thus is being reduced. Iron is being oxidized so the half-reaction should be flipped. This yields:
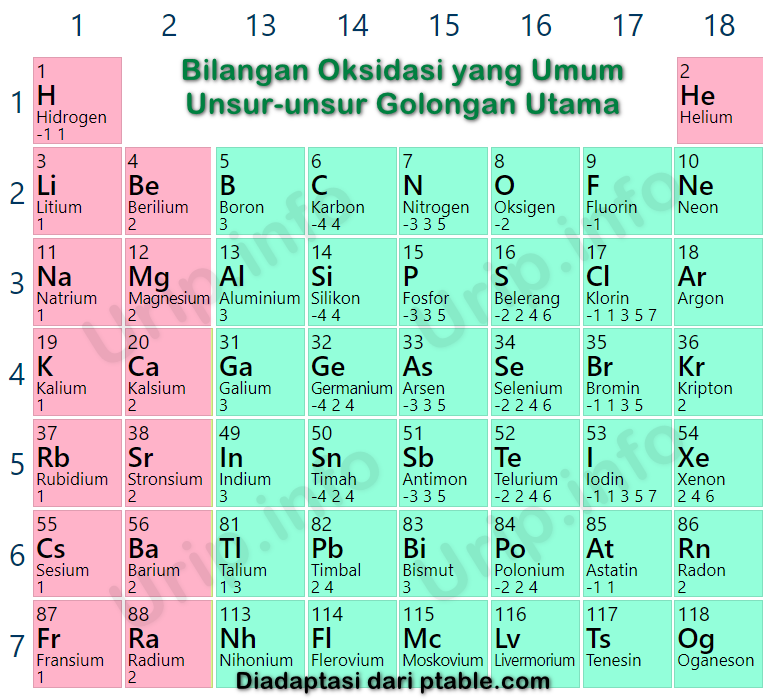
Bilangan Oksidasi Kimia Biloks Tabel Biloks Contoh Soal Dan Jawaban Riset
Penyetaraan reaksi disproporsionasi: IO3- + I- → I2 (suasana asam) menggunakan metode perubahan bilangan oksidasi (PBO).Reaksi setara: 2IO3- + 12H+ + 10I- →.

BAB 2 Penyetaraan Metode Biloks Ion_3 YouTube
A new noncentrosymmetric (NCS) and polar material containing two lone-pair cations, Bi3+ and I5+, and exhibiting an Aurivillius-type (Bi2O2)2+ layer has been synthesized and structurally characterized. The material, BiO(IO3), exhibits strong second-harmonic generation (SHG), ∼12.5 × KDP (or ∼500 × α-SiO2), using 1064 nm radiation, and is found in the NCS polar orthorhombic space group.
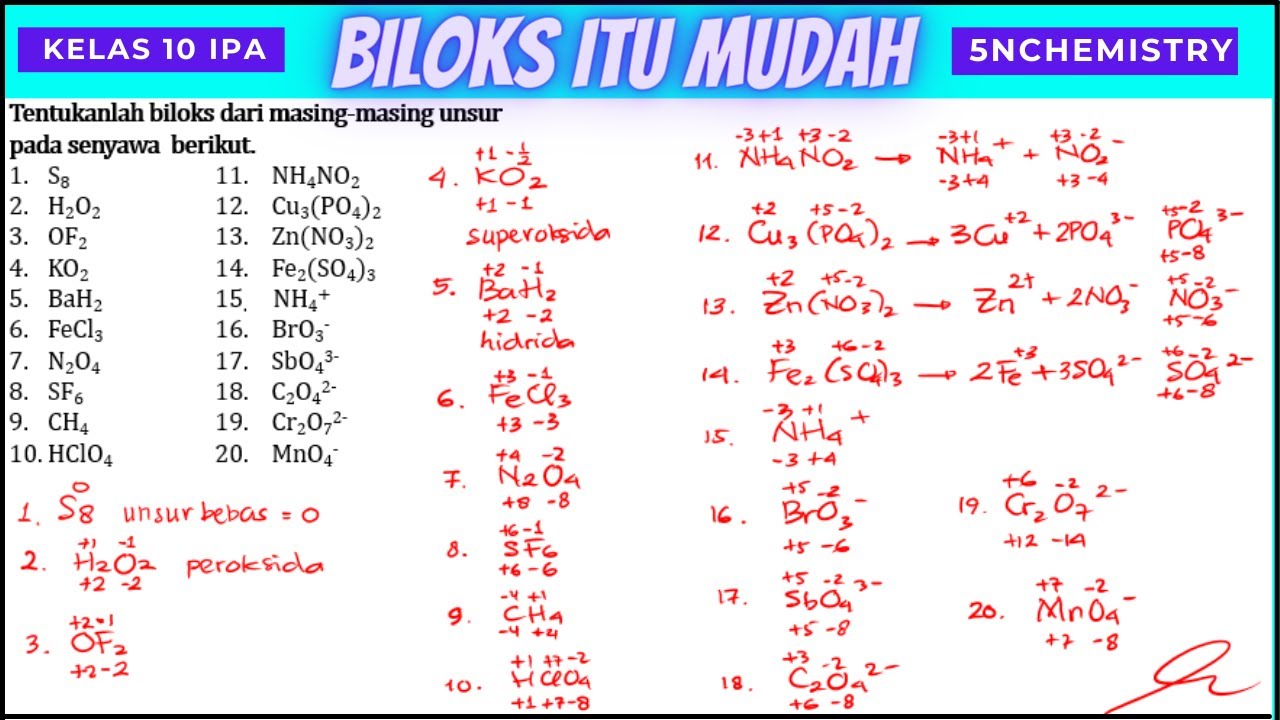
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
To calculate oxidation numbers of elements in the chemical compound, enter it's formula and click 'Calculate' (for example: Ca2+, HF2^-, Fe4 [Fe (CN)6]3, NH4NO3, so42-, ch3cooh, cuso4*5h2o ). The oxidation state of an atom is the charge of this atom after ionic approximation of its heteronuclear bonds. The oxidation number is synonymous with.

Penyetaraan Reaksi Redoks Metode Biloks YouTube
SO2- 3 +H2O → SO2- 4 + 2H+. Step 5: Balance charge. Add electrons to the side that needs more negative charge. Cr2O2- 7 +14H+ +6e- → 2Cr3+ +7H2O. SO2- 3 +H2O → SO2- 4 + 2H+ +2e-. Step 6: Equalize electrons transferred. Multiply each half-reaction by numbers to get the lowest common multiple of electrons transferred.