
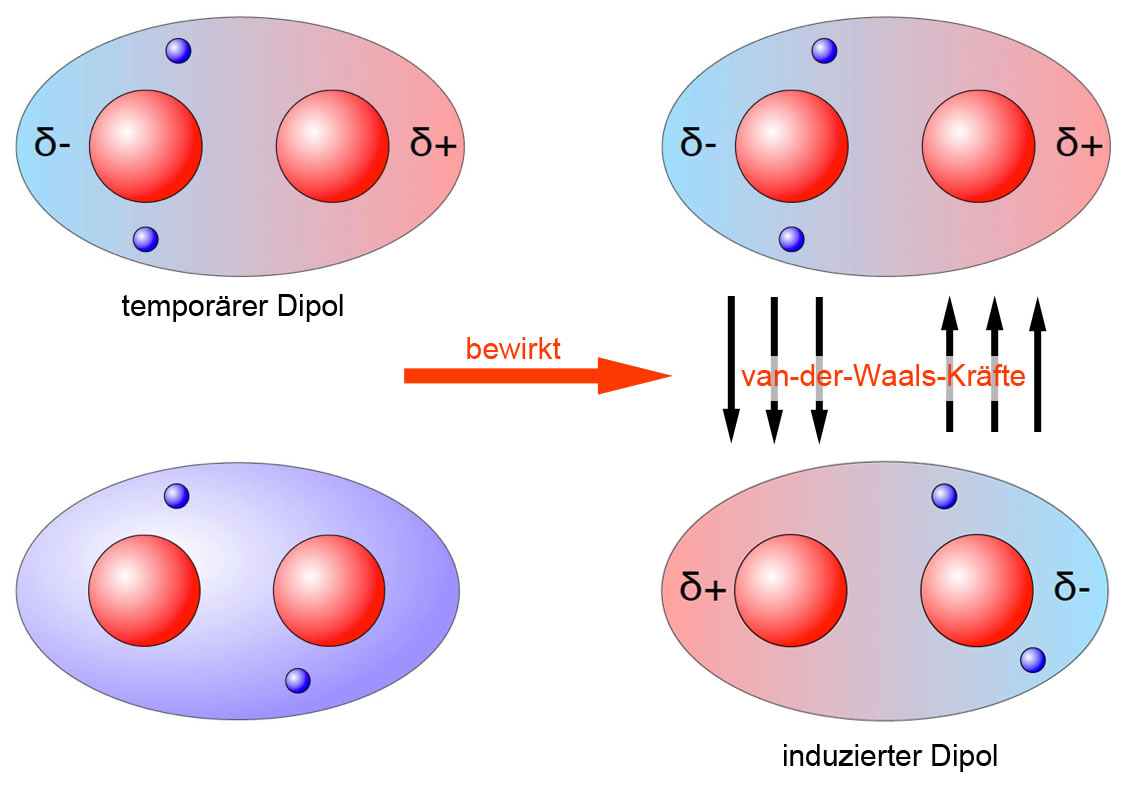
Pada gambar berikut ini, ikatan van der Waals gaya dipol...
Kesimpulannya itu adalah gaya Van Der waals merupakan gaya interaksi yang lemah yang berada di antara molekul yang melibatkan dipol. Kemudian molekul polar memiliki interaksi dipol yang permanen. Selanjutnya molekul non polar dapat berinteraksi dengan cara gaya dispersi London. Demikian pembahasan kali ini mengenai Gaya Van Der waals semoga.
PPT SURFACE FORCES PowerPoint Presentation, free download ID4032776
Karakteristik. Ciri-ciri utama gaya van der Waals adalah: [6] [7] lebih lemah dari ikatan kovalen dan ionik normal. Gaya Van der Waals bersifat aditif dan tidak dapat dijenuhkan.. Merupakan gaya jarak pendek dan oleh sebab itu hanya terjadi pada interaksi antar partikel terdekat (bukan semua partikel).
/91560215-56a133565f9b58b7d0bcfb65.jpg)
Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Pembahasan. Johannes Diderik Van der Waals berpendapat bahwa molekul-molekul dalam suatu zat tidak saling tolak menolak karena diantara molekul-molekul tersebut terdapat suatu gaya tarik menarik yang lemah. Gaya tarik menarik yang lemah ini disebut gaya Van der Waals.
What Is Van Der Waals Force
Kekuatan gaya tarik antar-molekul mampu menentukan apa yang akan terjadi. Gaya antar-molekul terbagi menjadi tiga macam, yakni gaya Van der Waals, ikatan hidrogen, dan gaya london. Contoh Gaya Antar-Molekul 1. Gaya Van der Waals Sesuai namanya, gaya Van der Waals pertama kali ditemukan oleh Johannes Van der Waals (1837—1923).

PPT Jenis Ikatan pada zat padat PowerPoint Presentation, free download ID5694744
Soal No. 1. Apa yang dimaksud dengan gaya van der Waals? Pembahasannya: Gaya Van der Waals adalah gaya tarik antar-molekul. Soal No. 2. Hal apa saja yang menunjukkan adanya gaya antar-molekul? Jelaskan. Pembahasannya: Gaya antar-molekul ditunjukkan dengan adanya adhesi maupun gaya kohesi.
SINTESIS KIMIA ORGANIK GAYA VAN DER WAALS
Jari-jari Van der Waals sama dengan setengah jarak antara dua atom yang tidak terikat ketika gaya elektrostatik di antara mereka seimbang. Dengan kata lain, itu adalah setengah dari jarak terdekat antara dua atom yang tidak terikat atau dalam molekul yang sama. Pikometer (pm) biasanya merupakan unit yang digunakan untuk melaporkan nilai.

GAYA VAN DER WAALS YouTube
Soal Persamaan Van der Waals. Hitung tekanan yang diberikan oleh 0,3000 mol helium dalam wadah 0,2000 L pada -25 °C menggunakan a. hukum gas idealb. persamaan van der Waals Apa perbedaan antara gas non-ideal dan ideal? Diketahui: a He = 0,0341 atm·L 2 /mol 2 b He = 0,0237 L·mol

Nanoteknologi dan Gaya Van Der Waals pada Kaki Cicak Baladena.ID
Komponen Gaya Van der Waals. Gaya Van der Waals adalah gaya antarmolekul yang paling lemah . Kekuatan mereka biasanya berkisar dari 0,4 kilojoule per mol (kJ/mol) hingga 4 kJ/mol dan bekerja pada jarak kurang dari 0,6 nanometer (nm). Ketika jaraknya kurang dari 0,4 nm, efek bersih dari gaya-gaya tersebut adalah tolak-menolak karena awan.
Ikatan hidrogen dan gaya van der waals
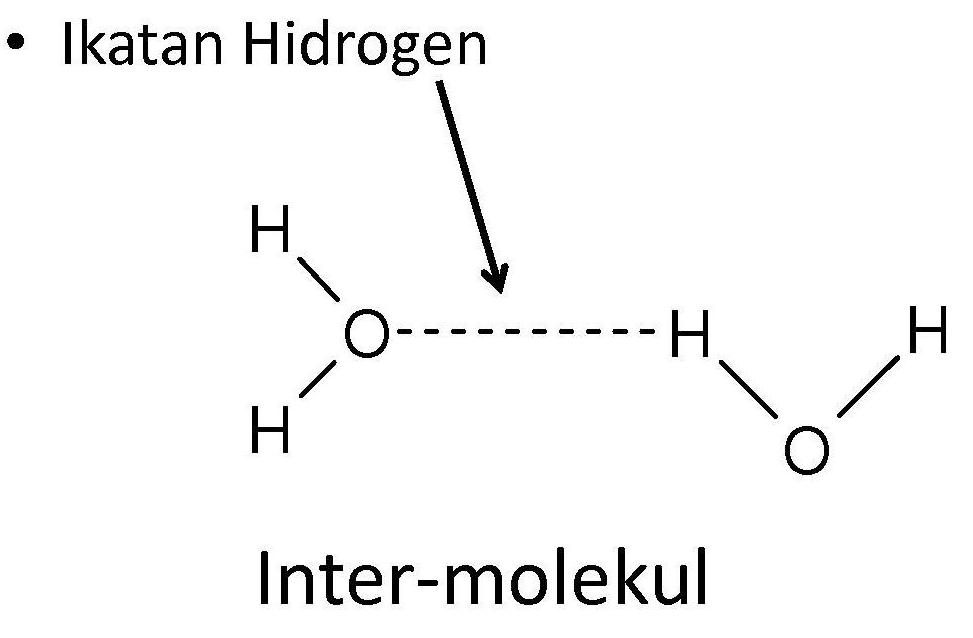
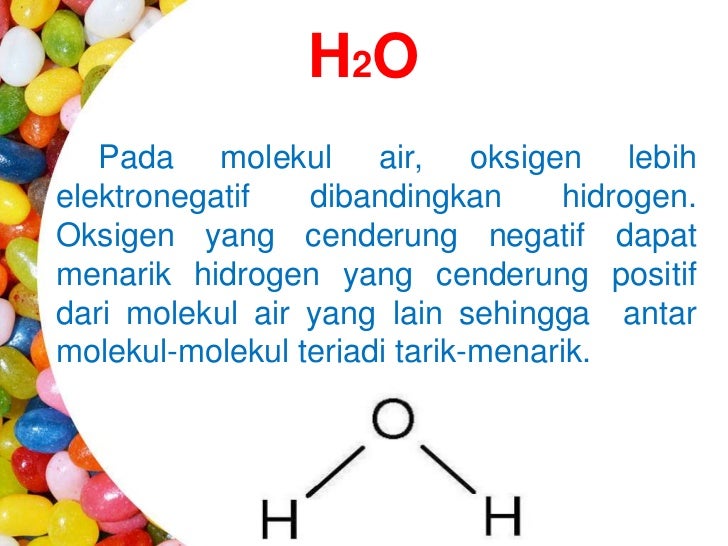
Interaksi antar partikel adalah gaya tarik antar partikel yang berdekatan. Ada tiga jenis interasi antar partikel, yaitu ikatan hidrogen, gaya van der waals, dan gaya london. Ketiga jenis interaksi antar partikel tersebut memiliki ikatan yang lebih lemah daripada ikatan ion dan ikatan kovalen yang mengikat atom dan ion menjadi satu dalam unsur dan senyawa.

SINTESIS KIMIA ORGANIK GAYA VAN DER WAALS
Pengertian Ikatan Van der Waals. Ikatan Van der Waals, dinamai dari ilmuwan Belanda Johannes Diderik van der Waals, adalah jenis ikatan intermolekuler yang timbul karena interaksi antara atom atau molekul tetangga. Ini adalah kekuatan daya tarik yang relatif lemah yang mempengaruhi struktur dan sifat materi.

Pembahasan 10 Soal (PG) Gaya Antarmolekul Van der Waals‼️ Lengkap YouTube
Pengertian Gaya van der Waals. Ada banyak sekali ikatan kimia yang mempengaruhi sifat fisika dan kimia suatu bahan kimia. Salah satunya adalah gaya van der Waals. Definisi gaya van der Waals adalah jumlah gaya tarik menarik atau tolak menolak antar molekul (atau antar bagian dalam molekul yang sama) selain yang disebabkan oleh ikatan kovalen maupun interaksi elektrostatik ion dengan molekul.

Apa yang Dimaksud dengan Gaya van der Waals? Mengapa Penting untuk Mempelajari Gaya Ini? 2023
KOMPAS.com - Gaya antarmolekul adalah gaya yang terjadi di antara atom-atom sehingga dapat membentuk molekul ataupun senyawa tertentu.. Gaya antarmolekul terdiri dari gaya London atau dipol-dipol, gaya Van der Waals, dan ikatan hidrogen.Simak penjelasannya seperti dikutip dari Encyclopaedia Britannica:. Gaya London. Gaya london adalah gaya tarik menarik antaratom karena adanya dipol sesaat.

Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Nitrogen is a gas at room temperature and liquefies at −195.8oC − 195.8 o C. Its neighbor on the periodic table (oxygen) boils at −182.95oC − 182.95 o C. The interactions between nitrogen molecules (N2) ( N 2) are weaker, so the boiling point is lower. Interactions between nonpolar molecules depend on the degree of electron fluctuation.

PPT GAYA ANTARMOLEKUL PowerPoint Presentation ID5701479
Sumber: van der Waals forces. Gaya Van der Waals atau disebut juga gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yaitu molekul-molekul dipol atau molekul polar. Gaya yang berasal dari gaya elektrostatik ini diusulkan pertama kalinya oleh Johannes Van der Waals (1837-1923).

Van der Waals Forces — Definition & Overview Expii
BAB III KESIMPULAN f1. Gaya Van Der Waals merupakan gaya tarik-menarik antara atom atau molekul, dimana gaya ini relatif jauh lebih lemah dibandingkan gaya yang timbul karena ikatan valensi 2. Sifat-sifat gaya Van Der Waals tersusun dari beberapa gaya tarik antar molekul, yaitu : Gaya Orientasi Gaya Induksi Gaya Dispersi 3. Ada tiga hal yang.

Gaya Van Der Waals PDF
Karakteritik dari Gaya Van Der Wals. 1. Gaya Van Der Waals bersifat aditif dan terdiri dari beberapa interaksi individu. 2. Gaya-gaya ini lebih lemah daripada ikatan kovalen, ionik, dan hidrogen. 3. Interaksi antar molekul meningkat ketika jarak antar molekul lebih kecil atau ketika mereka ditempatkan berdekatan.